同样的运动干预,为何有些人能借此显著改善血糖调控能力与胰岛素敏感性(即运动响应者),而另一部分人却收效甚微(被称为运动无响应者)?这一显著的个体应答差异,使得运动在糖尿病预防中的干预效果难以稳定复刻,极大制约了其作为普适性防治策略的推广与应用。目前已有研究证实,运动因子(exerkines)与肠道菌群是调控运动代谢应答的两大核心关键因素,但二者如何协同或互作,进而精准影响运动改善糖代谢与胰岛素敏感性的具体效果,其内在分子机制与调控通路仍未被系统阐明。
2025年11月,香港大学研究团队在Cell Metabolism上在线发表了题为“Gut microbiome-adipose crosstalk modulates soluble IL-6 receptor influencing exercise responsiveness in glycemic control and insulin sensitivity”的相关研究,通过代谢组学、宏基因组学等技术,结合临床发现+动物模型验证,阐述了sIL-6R(Soluble Interleukin 6 Receptor)是区分运动应答者与非应答者的关键因子,其水平变化与代谢改善直接相关,而肠道菌群-亮氨酸- mTOR/HIF1α/ADAM17-sIL-6R-脂肪炎症构成的肠道-脂肪串扰轴,是运动应答的核心调控机制。(麦特绘谱提供非靶代谢组学技术检测服务)
研究思路
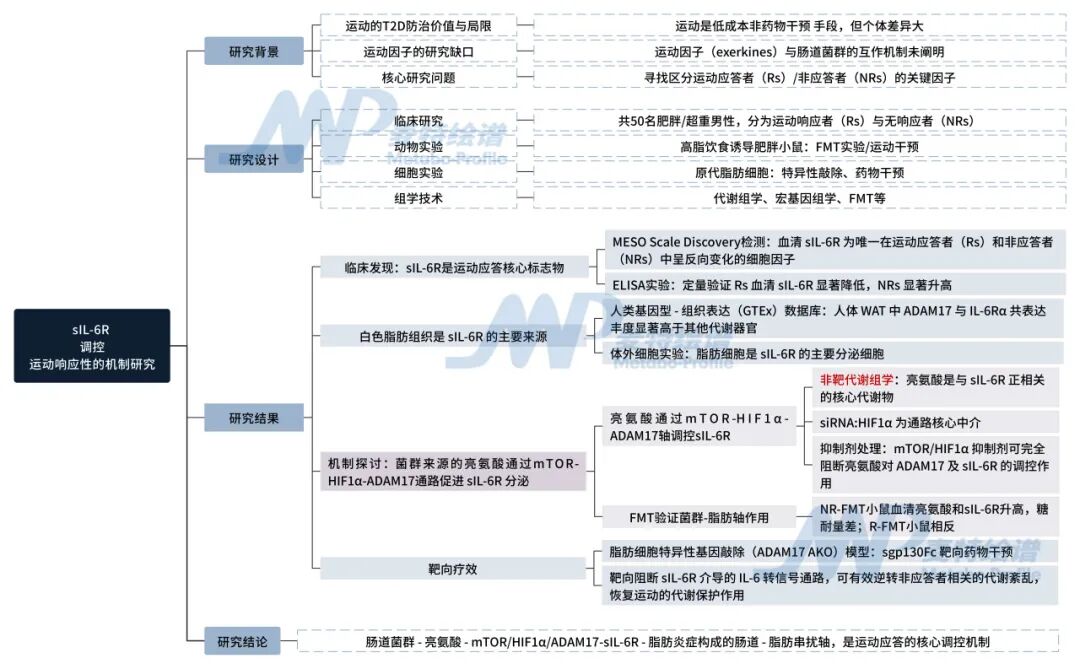
图1. 技术思路
研究结果
1. sIL-6R是运动响应性的关键因子
在12周高强度训练(HIT)干预后,运动应答者(Rs)与非应答者(NRs)的血清sIL-6R水平呈现显著反向变化。其中,Rs的血清sIL-6R水平从基线的42.98±13.70ng/mL显著降至37.68±13.31ng/mL;而NRs的血清sIL-6R水平则从41.11±8.86ng/mL显著升高至49.74±8.87ng/mL。
在整合发现队列与验证队列的50例样本中(Rs 36例、NRs 14例),上述差异趋势持续存在,且NRs的sIL-6R相对变化量较Rs高出30%。相关性分析显示,血清sIL-6R的相对变化量与空腹胰岛素水平及胰岛素抵抗指数的相对变化量均呈显著正相关。经基线体重指数(BMI)校正后,两组间sIL-6R水平的差异仍具有统计学意义,证实sIL-6R的变化独立于基线BMI,是反映运动代谢应答的特异性标志物。
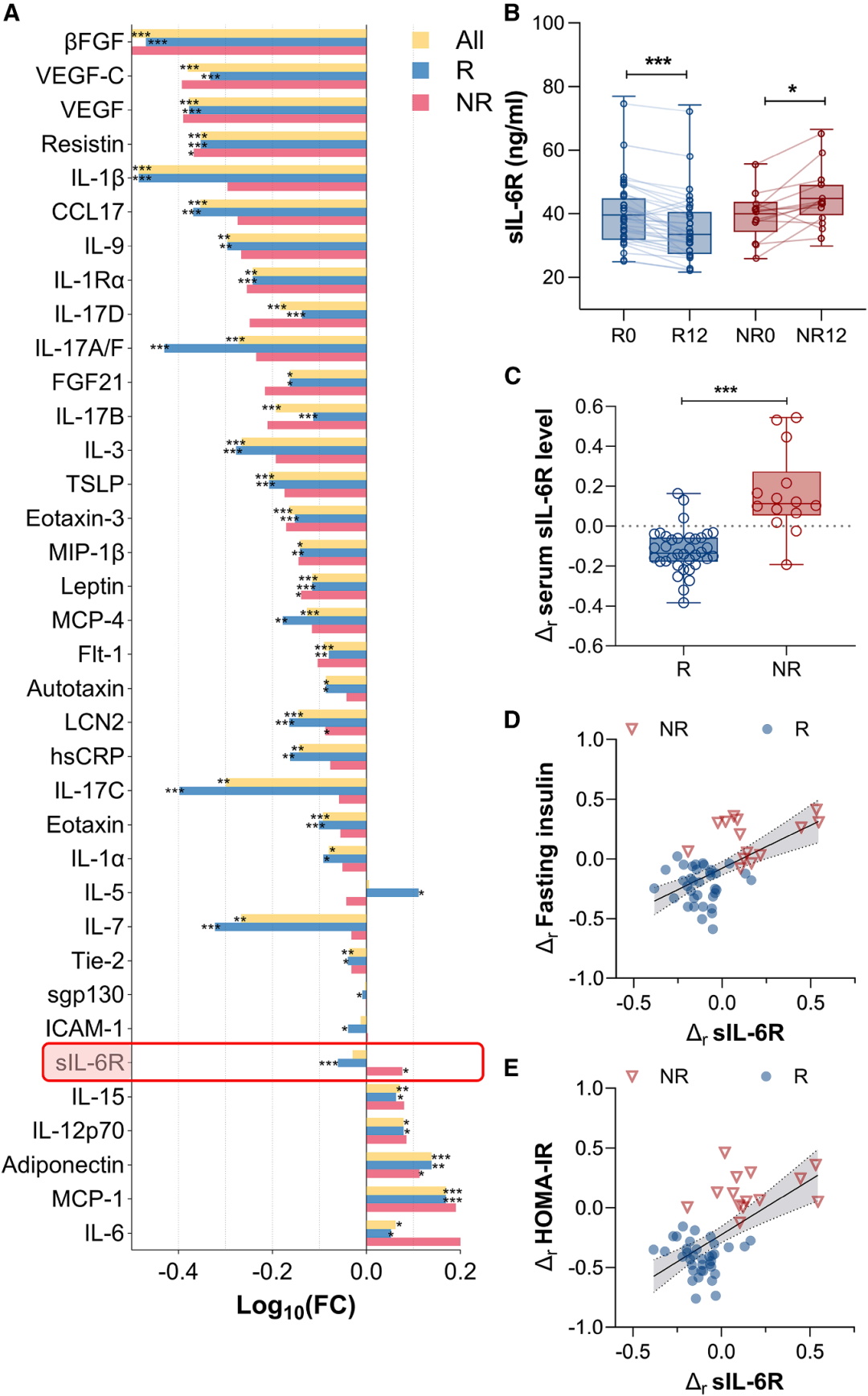 图2. 运动响应者和非响应者的sIL-6R水平差异
图2. 运动响应者和非响应者的sIL-6R水平差异
2. 脂肪组织是sIL-6R的主要来源
sIL-6R是由锚定在细胞膜上的IL-6Rα通过ADAM17水解产生的一种蛋白水解物。通过人类基因型组织表达(GTEx)数据库分析及小鼠多组织验证,发现ADAM17与IL-6Rα在WAT(白色脂肪组织)中呈高丰度共表达,其表达水平显著高于肝脏、骨骼肌、棕色脂肪组织(BAT)等其他代谢器官。进一步研究显示,高脂饮食(HFD)诱导的肥胖小鼠,其附睾白色脂肪组织(eWAT)和皮下白色脂肪组织(sWAT)中ADAM17与IL-6Rα的mRNA及蛋白表达水平均显著高于正常饮食(STC)喂养的瘦鼠。
体外组织培养实验证实,eWAT与sWAT分泌的sIL-6R水平显著高于BAT、肝脏及骨骼肌,且肥胖小鼠WAT的sIL-6R分泌量显著高于瘦鼠。细胞分群分析显示,WAT中成熟脂肪细胞的sIL-6R分泌量是基质血管组分(SVF)的2倍以上,且成熟脂肪细胞中ADAM17表达水平显著高于SVF,提示成熟脂肪细胞是WAT分泌sIL-6R的核心细胞群。尽管肺部也高表达ADAM17与IL-6Rα,但肥胖与瘦鼠间其表达水平无显著差异,且肺部sIL-6R分泌量在两组间无统计学差异,证实WAT而非肺部是肥胖状态下sIL-6R 升高的主要来源。
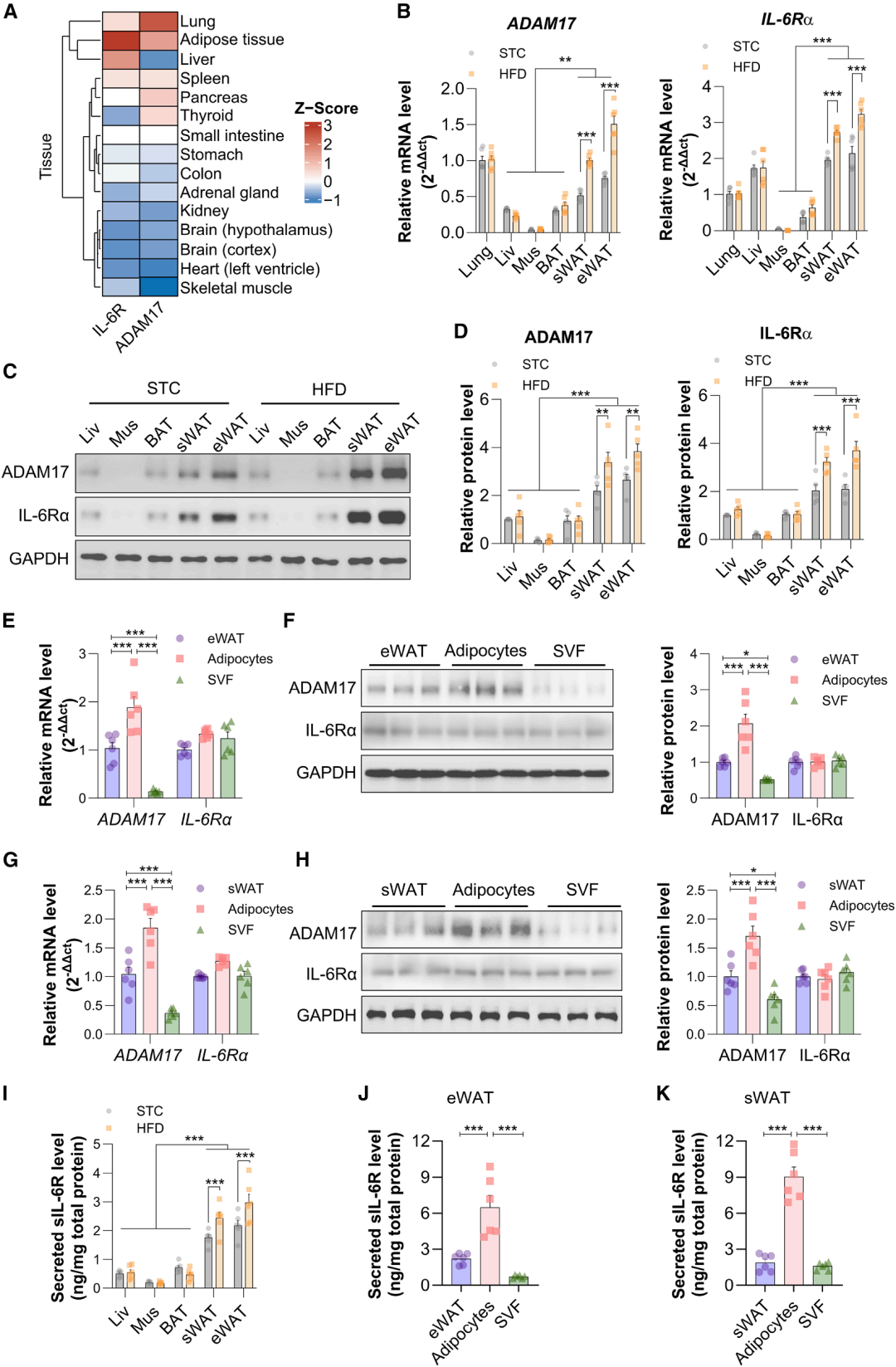
图3. 脂肪组织是肥胖患者sIL-6R升高的主要来源
3. 亮氨酸通过mTOR-HIF1α-ADAM17通路促进sIL-6R分泌
进一步探究运动干预后Rs组与NRs中sIL-6R差异变化的分子机制,代谢组学检测(麦特绘谱提供)结合关联分析显示,血清亮氨酸水平与sIL-6R水平呈显著正相关,且运动干预后Rs的血清亮氨酸水平显著降低,而NRs显著升高,提示亮氨酸可能参与sIL-6R的调控。体外细胞实验证实,亮氨酸以剂量依赖的方式促进小鼠原代脂肪细胞分泌sIL-6R,同时显著上调ADAM17的mRNA及蛋白表达,但对IL-6Rα表达无明显影响。
亮氨酸是众所周知的mTOR-p70S6激酶1(S6K1)的激活剂,通过调节HIF1α等多种转录因子来触发其下游的信号级联反应。使用mTOR抑制剂雷帕霉素预处理脂肪细胞,可完全阻断亮氨酸诱导的HIF1α、ADAM17表达及sIL-6R分泌;通过HIF1α特异性抑制剂或siRNA沉默HIF1α,同样可逆转亮氨酸的上述效应,表明mTOR-HIF1α-ADAM17通路是亮氨酸调控sIL-6R生成的核心机制。
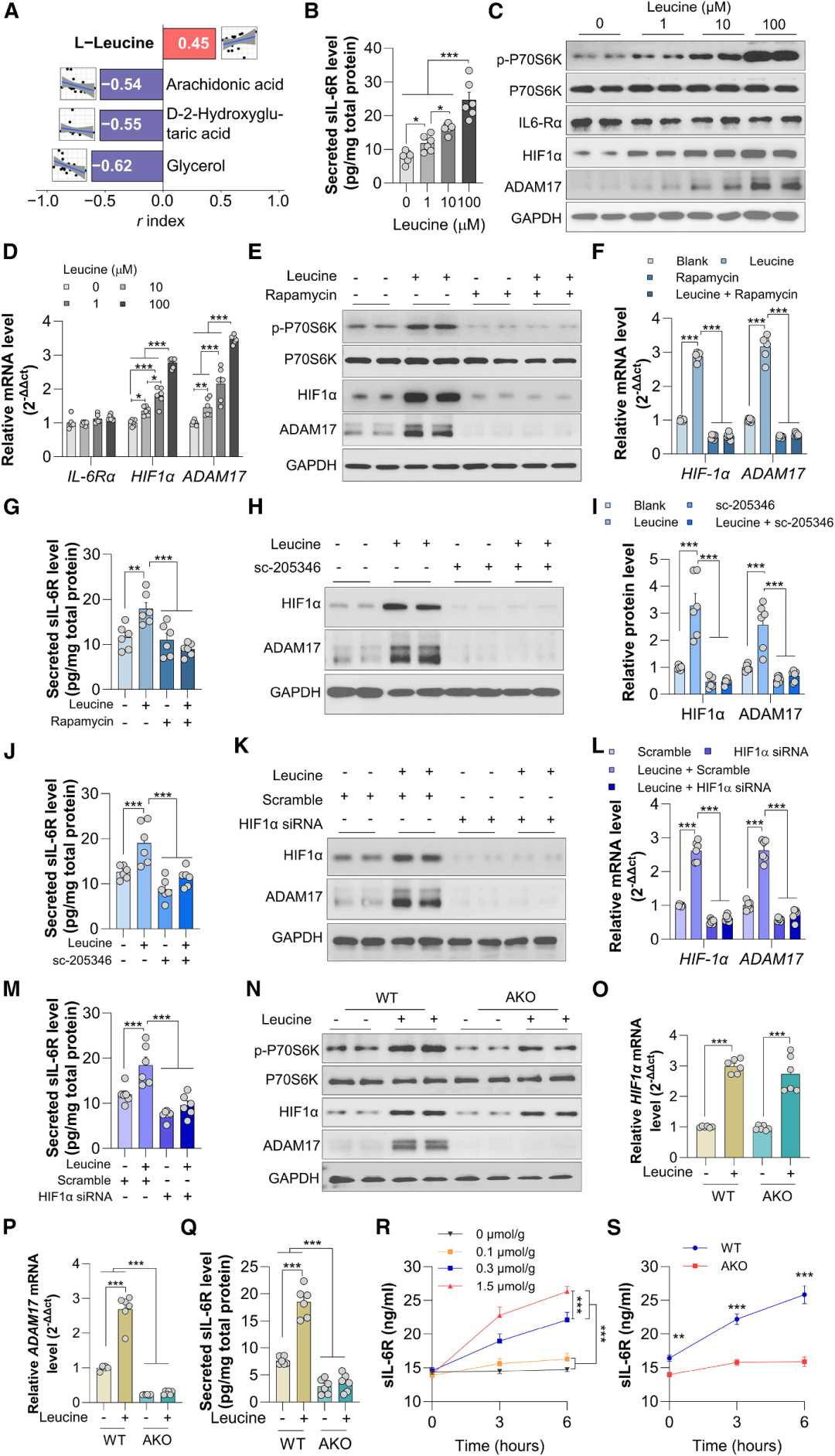
图4. 亮氨酸通过mTOR-HIF1α信号轴诱导脂肪细胞ADAM17表达和sIL-6R分泌
4. 肠道菌群调控亮氨酸水平,影响sIL-6R分泌
进一步探究Rs和NRs中sIL-6R的差异是否归因于肠道菌群依赖的亮氨酸,将Rs或NRs的粪便移植给抗生素预处理的肥胖小鼠(R-FMT组或NR-FMT组),结果显示NR-FMT组小鼠的血清亮氨酸及sIL-6R水平均显著高于R-FMT组及PBS对照组,且eWAT与sWAT中mTOR-HIF1α-ADAM17通路显著激活。抗生素处理可显著阻断NR-FMT诱导的亮氨酸及sIL-6R升高,证实肠道菌群是调控亮氨酸生成的关键因素。对R-FMT组小鼠进行4周亮氨酸补充,可显著升高其血清sIL-6R水平,同时激活WAT中的mTOR-HIF1α-ADAM17通路,逆转R-FMT带来的代谢益处,进一步证实肠道菌群介导的亮氨酸是调控sIL-6R及运动应答的关键上游分子。
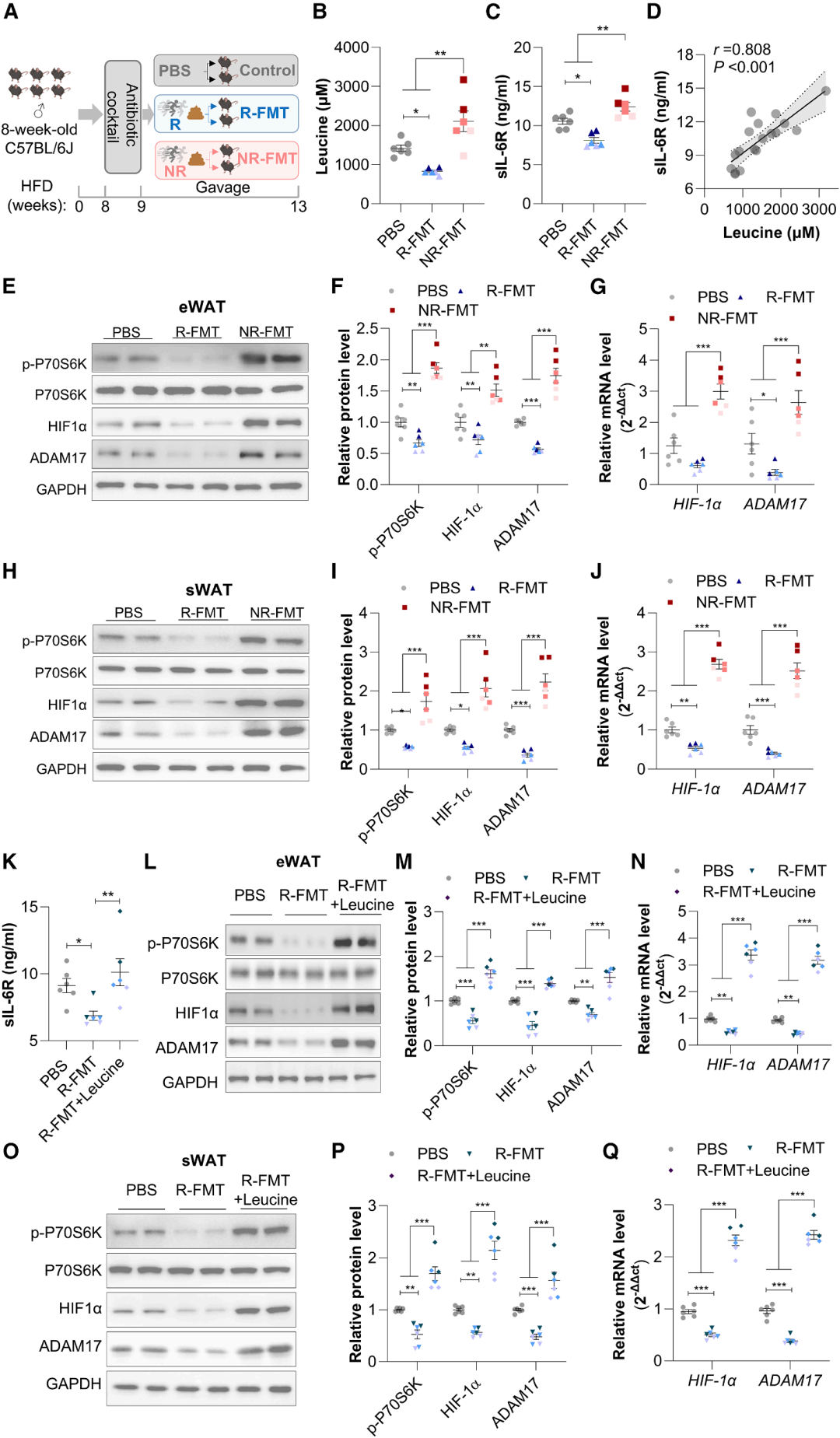
图5. 肠道菌群调控亮氨酸水平,影响sIL-6R分泌
5. 阻断sIL-6R可恢复运动无响应者的代谢改善
脂肪细胞特异性ADAM17敲除(ADAM17 AKO)小鼠实验显示,与野生型(WT)小鼠相比,ADAM17 AKO小鼠接受NR-FMT后,血清sIL-6R水平显著降低,同时空腹血糖、胰岛素水平显著改善,葡萄糖耐量及胰岛素敏感性明显提升。使用sIL-6R特异性阻断剂sgp130Fc干预NR-FMT小鼠,可显著降低其空腹及进食状态下的血糖、胰岛素水平,改善葡萄糖耐量及胰岛素敏感性,但对PBS对照组小鼠无明显影响。上述结果证实,靶向阻断sIL-6R介导的IL-6转信号通路,可有效逆转非应答者相关的代谢紊乱,恢复运动的代谢保护作用。
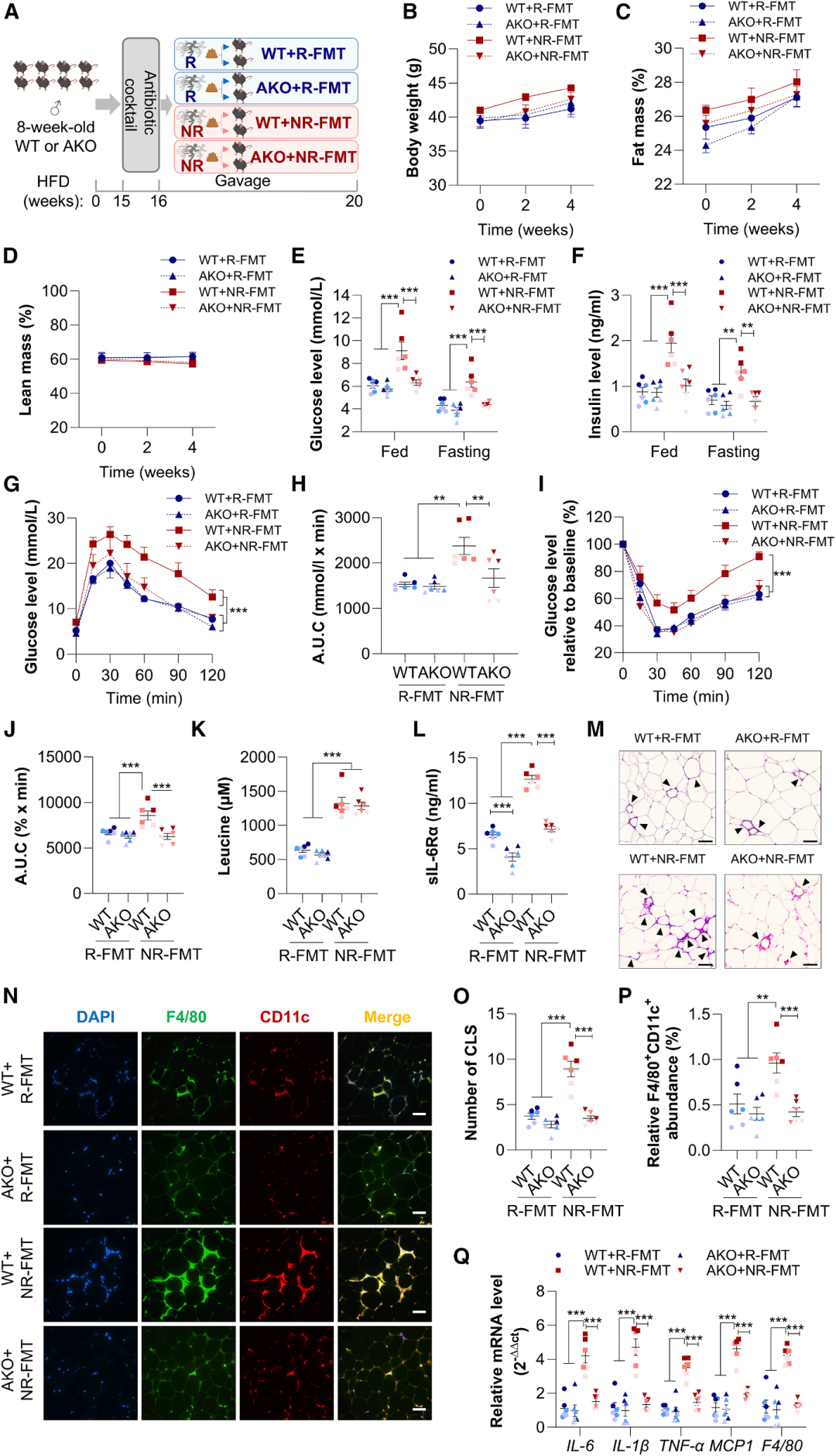
图6. 靶向脂肪细胞ADAM17或sIL-6R可恢复非应答者的运动代谢益处
研究结论
本研究发现sIL-6R是区分运动应答者与非应答者的关键生物标志物,其水平变化与代谢改善直接相关。肠道菌群-亮氨酸-mTOR/HIF1α/ADAM17-sIL-6R -脂肪炎症构成的肠道-脂肪串扰轴,是运动应答的核心调控机制。靶向脂肪细胞ADAM17或sIL-6R的干预策略,可优化个性化运动方案,提升糖尿病预防效果。
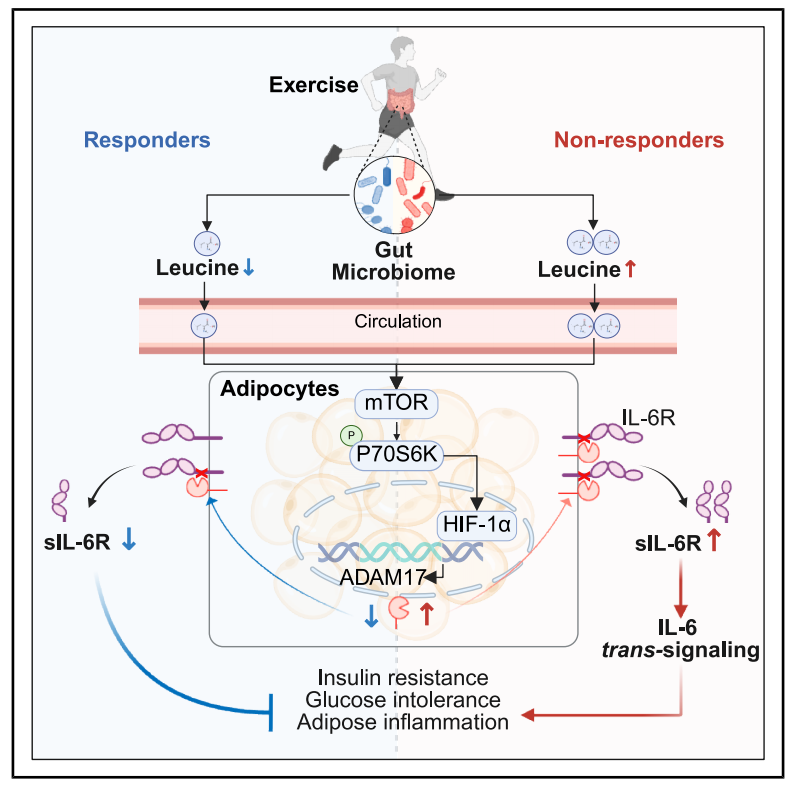
参考文献
Gut microbiome-adipose crosstalk modulates soluble IL-6 receptor influencing exercise responsiveness in glycemic control and insulin sensitivity. Cell Metabolism. 2025
绘谱帮你测
本研究通过麦特绘谱提供的非靶向代谢组学技术发现亮氨酸是影响sIL-6R的关键代谢物,为后续阐明肠道菌群-亮氨酸-sIL-6R介导的肠道-脂肪串扰轴在运动应答中的调控作用提供了关键切入点。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱已为数百家三甲医院、科研院所和企业提供多组学一站式整体解决方案,协助客户与合作伙伴发表SCI文章600+篇,累计影响因子6000+,平均IF>10,涵盖Cell, Science, Nature, Cancer Cell, Signal Trans-duction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等期刊。
